باتری با رابط الکترولیت دوتایی تعادل جریان در الکترولیت، تعادل جریان در الکترودها، تعادل جرم نمک، و تعادل جرم گونههای درگیر مانند هیدروژن در باتری نیکل-فلز هیدرید را تعریف میکند.
الکترولیت در باتریهای مدلسازیشده باید یک الکترولیت قلیایی باینری ساکن 1:1 باشد که حاوی یک کاتیون ( Cat + ) و یک آنیون ( An- ) باشد.
رابط فیزیک پنج متغیر وابسته را حل می کند:
• |
• |
• | Δs |
• | c s ، غلظت یک گونه درگیر در ذرات الکترود |
• | c l ، غلظت نمک الکترولیت |
در الکترولیت و الکترولیت منفذی دو متغیر l و c l تعریف شده است . با فرض الکتروخنثی بودن، c l هم غلظت Cat + و هم غلظت An – را نشان می دهد .
معادلات دامنه در الکترولیت حفظ جریان و تعادل جرم برای نمک بر اساس موارد زیر است:
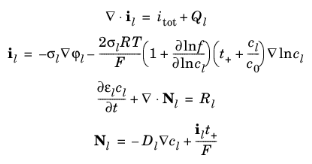
که در آن i l چگالی جریان الکترولیت، σ l هدایت الکترولیت، f ضریب فعالیت نمک، t + عدد انتقال برای Cat + (که عدد انتقال نیز نامیده می شود)، i مجموع همه منابع جریان الکتروشیمیایی، c 0 را نشان می دهد. غلظت حلال، و Ql نشان دهنده یک منبع جریان الکترولیت دلخواه است . در تعادل جرم نمک، Nl نشان دهنده شار کاتیون، εl کسر حجمی الکترولیت است .D l میزان انتشار نمک الکترولیت، و Rl کل عبارت Cat + منبع در الکترولیت.
در الکترود، چگالی جریان، i s ، به صورت تعریف شده است
که در آن σ رسانایی الکتریکی است .
معادله دامنه برای الکترود، بقای جریان است که به صورت بیان شده است
که در آن Qs یک عبارت منبع جریان دلخواه است .
واکنش ها روی سطح ذرات میزبان کروی کوچک جامد با شعاع r p رخ می دهد . واکنشها میتوانند الکتروشیمیایی یا واکنشهای جذب/واجذب شیمیایی بدون الکترون باشند.
واکنش های الکتروشیمیایی شامل کاتیون ها یا آنیون ها است و به طور کلی به صورت نوشته می شوند
که در آن Θ s یک مکان واکنش آزاد و S Θ s یک مکان واکنش اشغال شده در سطح ذرات جامد است. گونه های محصول اضافی (X، …) توسط این رابط فیزیک اداره نمی شود.
واکنشهای شیمیایی جذب/واجذبی که شامل گونههای باردار نمیشوند و عموماً به صورت زیر نوشته میشوند:
با سرعت واکنش k (واحد SI: mol/(s·m 2 )). علامت ν s در اینجا مثبت است و سرعت واکنش برای واکنش هایی که از چپ به راست می روند مثبت تعریف می شود.
غلظت Θ s لازم نیست حل شود زیرا غلظت کل مکان های واکنش، c s , max ثابت فرض می شود، به این معنی که
یک پارامتر مهم برای الکترودهای بینابینی، متغیر حالت بار شارژ برای ذرات جامد است که به صورت تعریف شده است.
پتانسیل تعادل Eq واکنش های الکترودهای بینابینی معمولاً توابع soc هستند .
واکنشها فقط روی سطح ذرات اتفاق میافتد، اما گونههای اینترکالانت میتوانند با انتشار درون ذرات منتقل شوند. در درون ذرات، تعادل جرم را می توان به صورت نوشتاری نوشت
که در آن c s غلظت گونه های درگیر است. این معادله به صورت محلی توسط این رابط فیزیک در یک بعد اضافی (شبه) یک بعدی، با استفاده از گسسته سازی المان محدود با غلظت فاز جامد به عنوان متغیر وابسته حل می شود. عملگر واگرایی و گرادیان در معادله فوق با استفاده از مختصات کروی، استوانه ای یا دکارتی، بسته به نوع ذره (کره، استوانه، یا پولک) اعمال می شود.
شرایط مرزی به شرح زیر است:
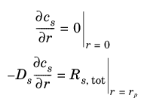
که در آن R s ، tot کل شار مولی سطحی گونه های درگیر به دلیل واکنش های الکتروشیمیایی و شیمیایی است.
نمادهای استوکیومتری مورد استفاده در رابط فیزیک مطابق با واکنش الکتروشیمیایی عمومی است که در زیر بیان شده است:
که در آن ضرایب استوکیومتری , νi , مثبت ( ν ox ) برای محصولات و منفی ( ν قرمز ) برای واکنش دهنده ها در واکنش احیا است. از این تعریف، تعداد الکترون ها، n ، در واکنش الکترود را می توان بر اساس محاسبه کرد
جایی که z i نشان دهنده بار گونه i است .
در الکترودهای متخلخل، i tot نشاندهنده مجموع تمام سهمهای چگالی جریان انتقال بار بر اساس:
که در آن A v سطح خاص را نشان می دهد. عبارت منبع در تراز جرم از زیر محاسبه می شود:
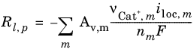
همچنین می توان منابع واکنش اضافی، Rl , src را که به کل منبع گونه کمک می کند، با توجه به موارد زیر مشخص کرد:
در سطح ذرات جامد شما آن را دارید
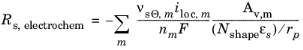
که در آن آخرین فاکتور (معمولاً برابر با 1) یک ضریب پوسته پوسته شدن است که تفاوتهای بین سطح ( Av ,m ) مورد استفاده برای محاسبه چگالی جریان حجمی و مساحت سطح ذرات در مدل انتشار لیتیوم جامد را محاسبه میکند. شکل N برای مختصات دکارتی 1، برای استوانه ای 2 و برای مختصات کروی 3 است.
مساحت سطح معمولاً از کسر حجمی الکترود، اندازه ذرات و شکل مطابق با آن به دست می آید
اگر ضریب انتشار فاز جامد بسیار بزرگ باشد و/یا اگر شیب غلظت مکانی در ذره را بتوان نادیده گرفت، تکامل غلظت فاز جامد در زمان را می توان از
منبع مولی، Rv ، tot ، به دلیل واکنش های الکتروشیمیایی و شیمیایی در الکترودهای مثبت و منفی به صورت زیر ارائه می شود :
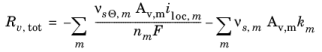
یک لایه مقاومتی (همچنین به نام رابط جامد الکترولیت، SEI ) ممکن است روی ذرات جامد تشکیل شود که منجر به تلفات پتانسیل اضافی در الکترودها شود. برای مدلسازی مقاومت فیلم، یک متغیر راهحل اضافی برای تغییرات پتانسیل روی فیلم، Δs  ، فیلم ، در رابط فیزیک معرفی میشود. سپس معادله حاکم بر اساس آن است
، فیلم ، در رابط فیزیک معرفی میشود. سپس معادله حاکم بر اساس آن است
که در آن فیلم R (واحد SI: Ω · m 2 ) نشان دهنده مقاومت فیلم تعمیم یافته است. مازاد پتانسیل فعالسازی، ηm ، برای همه واکنشهای الکترود در الکترود، یک سهم پتانسیل اضافی دریافت میکند که نتیجه میدهد .
همچنین می توان یک واکنش الکترود را در سطح مشترک بین یک الکترولیت و یک هادی جامد مدل کرد. به طور معمول یک واکنش علاقه می تواند باشد
که در آن Y می تواند مقداری فلز باشد که روی سطح الکترود رسوب کرده است. از آنجایی که این یک واکنش درج نیست، cs هیچ ارتباطی در این مرز ندارد. ضرایب استوکیومتری واکنش فوق عبارتند از:
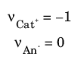
این منجر به شرایط مرزی زیر برای شار گونه در سطح مشترک الکترود – الکترولیت می شود
و شرایط زیر برای جریان ها:
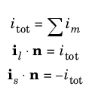
جایی که بردار نرمال n به حوزه الکترولیت اشاره می کند.
توزیع اولیه شارژ در سلول باتری
تعداد پارامترها در مدلهای باتری بسیار زیاد است، اما بهویژه تنظیم توزیع بار در سلول (یعنی غلظت گونههای متقابل در هر ماده الکترود) همیشه ساده نیست زیرا اغلب به اطلاعات دقیقتری از ولتاژ و ظرفیت سلول نیاز دارد.
با این حال، می توان توزیع بار اولیه را با در نظر گرفتن اینکه در ابتدا، زمانی که هیچ جریانی روی سلول باتری اعمال نمی شود و منابع قطبش اعمال نمی شود، محاسبه کرد، تنها تفاوت بین پتانسیل تعادل مواد الکترود مثبت و منفی است که دیکته می کند. ولتاژ سلول دو محدودیت را می توان با ظرفیت و ولتاژ سلول باتری به عنوان ورودی برای این محاسبه تنظیم کرد:
• | ظرفیت سلول باتری، سلول Q ، 0 (واحد SI: C)، برابر است با مجموع بار گونه های قابل چرخش، سیکل Q ، در الکترودهای مثبت و منفی: |
بار گونه قابل چرخش در یک الکترود به صورت زیر تعریف می شود:
که در آن ε s کسر حجمی الکترود را نشان میدهد و cs ، avg ، چرخه، الکترود میانگین غلظت محلی گونههای قابل چرخش است که به صورت زیر تعریف میشود:
cs ,avg میانگین غلظت گونه است که در ابتدا، زمانی که هیچ گرادیان غلظتی در ذرات الکترود وجود ندارد، برابر با غلظت سطح ذرات الکترود، cs , surf است . soc min حداقل میزان بار مجاز در مواد الکترود است.
• | پتانسیل الکترود در هر الکترود ثابت است و اختلاف پتانسیل الکترود مثبت و منفی برابر با ولتاژ سلول است. |
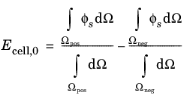
در ابتدا، زمانی که قطبش در سلول وجود ندارد، بیان برابر است با تفاوت در پتانسیل مدار باز مواد الکترود، Eq :
ولتاژ سلول به پتانسیل مدار باز مواد الکترود محدود می شود و ولتاژ سلول باید در محدوده زیر تنظیم شود:
که در آن زیرنویس max و min از حالت شارژ الکترود نشان دهنده حداکثر و حداقل مقدار مجاز گونه های درونی بر حسب حالت بار در مواد الکترود است.
از طرف دیگر، محدودیت دوم را می توان با دیگری جایگزین کرد تا اجازه دهد ورودی ولتاژ سلول اولیه با حالت شارژ اولیه سلول جایگزین شود:
• | وضعیت شارژ سلول، سلول سوسیال ، 0 (بدون ابعاد)، ظرفیت سلول باتری را به شارژ گونه های قابل چرخش در هر الکترود مرتبط می کند. |
حالت شارژ سلول بین 0 تا 1 است. حالت شارژ 0 نشان می دهد که سلول کاملاً تخلیه شده است و اگر 1 باشد سلول کاملاً شارژ شده است.
متعادل کردن الکترودها
تعادل الکترودها در سلول به این معنی است که مقدار ماده فعال الکترود در هر الکترود پس از ظرفیت سلول باتری طراحی می شود. به عبارت دیگر، ظرفیت گونههای چرخهپذیر را میتوان به طور کامل در الکترود مثبت یا منفی بدون داشتن مواد اضافی استفاده نشده و برای حفظ غلظت گونههای درونگیر در پنجره وضعیت شارژ مشخص شده میزبانی کرد. برای باتری ها این امر برای به حداکثر رساندن چگالی انرژی و طول عمر و گاهی اوقات به دلایل ایمنی از اهمیت بالایی برخوردار است.
رابط باتری می تواند بخش های حجمی الکترود را تامین کند که الکترودها را متعادل می کند. اینها با اتصال مقدار ماده میزبان فعال – یعنی حداکثر مقدار گونههای قابل چرخش در الکترود – به ظرفیت اولیه سلول محاسبه میشوند. در اینجا، ماده میزبان فعال در الکترود مثبت برابر با ظرفیت سلول تنظیم می شود. در برخی از شیمی باتری ها، به عنوان مثال باتری های لیتیوم یون، مقدار ماده میزبان در هر دو الکترود منحرف می شود. به خصوص، الکترودهای مبتنی بر کربن منفی اغلب در مقایسه با الکترود مثبت بیش از حد تنظیم میشوند تا تلفات برگشتناپذیر در سلول را در حین کار ایجاد کنند. گونه های قابل چرخش در برخی موارد می توانند مستقیماً پس از مونتاژ سلولی از بین بروند. بنابراین روابط زیر اعمال می شود:
که در آن میزبان Q (واحد SI: C) مقدار ماده میزبان فعال، چرخه f ، از دست دادن کسری گونههای چرخهپذیر، و f میزبان، منفی، خارج از مازاد کسری ماده میزبان فعال منفی است.
برای محاسبه کسر حجمی الکترود، این واقعیت که مقدار ماده میزبان فعال را می توان از معادله زیر محاسبه کرد، باید در نظر گرفته شود:
جایی که Δ soc پنجره حالت شارژ مجاز ماده الکترود است.
بنابراین بیان کسر حجمی الکترود در هر الکترود به صورت زیر است:
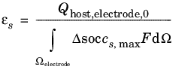
از کسر حجمی الکترود نشان داده شده است که ظرفیت سلول باتری باید با دقت انتخاب شود، زیرا ظرفیت توسط مواد و اندازه الکترود محدود می شود. ظرفیت هرگز نباید طوری تنظیم شود که کسر حجمی الکترود بزرگتر از 1 باشد.




