در محلول های الکترولیت ، نمک را می توان اضافه کرد تا رسانایی الکترولیت بالایی ایجاد کند و تلفات اهمی را در یک سلول کاهش دهد. این محلول ها اغلب الکترولیت های پشتیبان نامیده می شوند، محلول های بافر یا الکترولیت های حامل. گونه های اضافه شده، یک جفت یون منفی و مثبت، بر همه گونه های دیگر غالب است. بنابراین، گونههای الکترولیت پشتیبان میتوانند بر انتقال جریان در محلول غالب باشند. علاوه بر این، یونهای پشتیبان غالب معمولاً طوری انتخاب میشوند که در سطوح الکترود واکنش نشان ندهند، زیرا رسانایی بالا باید در طول فرآیند حفظ شود، یعنی نباید گونههای فعال الکتریکی باشند. این همچنین به این معنی است که گرادیان غلظت گونه های غالب در یک الکترولیت پشتیبان معمولاً ناچیز است.
مدلسازی و حل یک الکترولیت پشتیبان در واسطهای توزیع جریان الکترواستاتیک یا ثانویه، توزیع پتانسیلی را ارائه میدهد که مهاجرت را در واسط انتقال گونههای رقیقشده هدایت میکند.
بردار چگالی جریان متناسب با مجموع شارهای گونه ها است که توسط قانون فارادی بیان می شود:
شرایط خنثی الکتریکی تضمین می کند که همیشه یک بار خالص در هر موقعیتی در محلول رقیق وجود دارد. به طور شهودی، این بدان معنی است که ایجاد جریان با پمپاژ دستی یون های مثبت در یک جهت و یون های منفی در جهت دیگر غیرممکن است. بنابراین، عبارت همرفتی لغو می شود تا عبارت زیر را برای چگالی جریان الکترولیت به دست دهد، که در آن j نشان دهنده گونه های حمایت کننده است:
(12-8)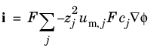
معادله 12-8 به سادگی قانون اهم برای انتقال جریان یونی است و می توان آن را ساده کرد
(12-9)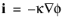
که در آن κ رسانایی الکترولیت پشتیبان است. تعادل جریان، چگالی جریان و پتانسیل را در سلول نشان می دهد
که در ترکیب با معادله 12-9 به دست می آید :
(12-10)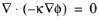
معادله 12-10 را می توان به راحتی با استفاده از واسط توزیع جریان الکترواستاتیک یا ثانویه حل کرد و هنگامی که با رابط حمل و نقل در گونه های رقیق کوپل شد، توزیع پتانسیل در عبارت مهاجرت نشان داده می شود.




