راه حل تعدادی از پایین ترین مقادیر ویژه را ارائه می دهد.
سه عدد کوانتومی ( n ، l ، m ) حالت های ویژه اتم هیدروژن را مشخص می کند:
|
•
|
n عدد کوانتومی اصلی است.
|
|
•
|
l عدد کوانتومی زاویه ای است.
|
|
•
|
m عدد کوانتومی مغناطیسی است.
|
این اعداد کوانتومی مستقل نیستند اما دارای روابط متقابل زیر هستند:
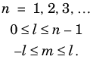
یک عبارت تحلیلی برای مقادیر ویژه انرژی بر حسب عدد کوانتومی n وجود دارد
جایی که
(4-4)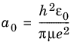
این عبارت شعاع بور نامیده می شود و مقدار تقریبی آن 3·10-11 متر است .
سه مقدار ویژه انرژی، طبق عبارت فوق با μ≈ m e ، عبارتند از :
|
•
|
E 1 ≈ – 2.180 10 – 18 J
|
|
•
|
E 2 ≈ – 5.450 · 10 – 19 J
|
|
•
|
E 3 ≈ – 2.422 · 10 – 19 J
|
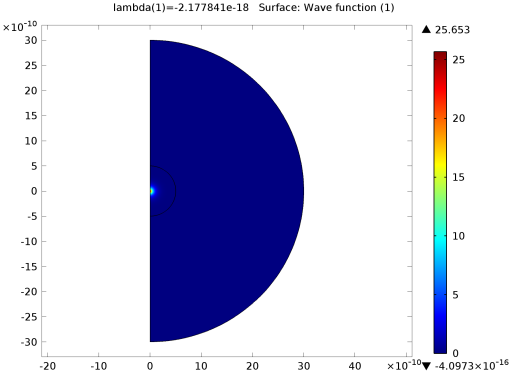
شکل 4-1: تابع موج ψ برای اولین مقدار ویژه انرژی.
با مقایسه این اعداد با مقادیر ویژه محاسبه شده، می توانید یک انحطاط 2 برابری برای n = 2 و یک انحطاط 3 برابری برای n = 3 مشاهده کنید. این انحطاط با سه گانه کوانتومی زیر مطابقت دارد: (2,0,0) و (2) ,1,0)؛ (3،0،0)، (3،1،0)، و (3،2،0). مقادیر محاسبه شده به دلیل حل عددی تقریبی از هم جدا می شوند.
با پالایش مش و حل مجدد، می توانید به نتایج دقیق تری برسید. حالات با l = 0 مربوط به راه حل های کروی متقارن هستند، در حالی که حالت های با l = 1 یا 2 مربوط به حالت هایی با یک یا دو سطح گره شعاعی هستند. سطح انرژی 0 مربوط به انرژی الکترون آزاد است که دیگر محدود به هسته نیست. سطوح انرژی نزدیک به 0 مربوط به حالت های برانگیخته است.
تابع موج به خودی خود هیچ تفسیر فیزیکی مستقیمی ندارد. کمیت دیگر برای رسم ⏐Ψ⏐ 2 است که متناسب با تابع چگالی احتمال (غیر عادی) برای موقعیت الکترون پس از ادغام حول محور z است . نمودار تابع چگالی احتمال غیر عادی را نشان می دهد.
برای تعیین انرژی حالت پایه، می توانید از پالایش مش تطبیقی استفاده کنید.




