ماژول طراحی باتری تعدادی رابط فیزیکی برای مدل سازی باتری ها دارد. انتخاب رابط فیزیک به هدف کلی مدل بستگی دارد.
مدل های سلولی دقیق
هنگام مطالعه شیمی سلول، پیری یا نرخ شارژ-دشارژ بالا، معمولاً لایههای مختلف باتری را با استفاده از مدلهای وابسته به فضا در مقیاس میکرومتر بررسی میکنیم، در حالی که مدلهای درشتتر برای محاسبه منابع گرما یا پیشبینی رفتار ولتاژ برای شارژ کم یا متوسط. نرخ تخلیه ممکن است از یک رویکرد مدل سازی یکپارچه تر استفاده کند.
مدلهای باتری وابسته به فضا اغلب سلولهای واحد را مدلسازی میکنند که شامل موارد زیر است:
الف) کلکتورهای جریان و فیدرهای جریان
ب) الکترودهای فلزی متخلخل یا جامد
ج) الکترولیت جداکننده آند و کاتد
برای مثال، برخی از فرآیندهای شارژ و دشارژ در یک باتری قابل شارژ را در زیر شرح می دهیم.
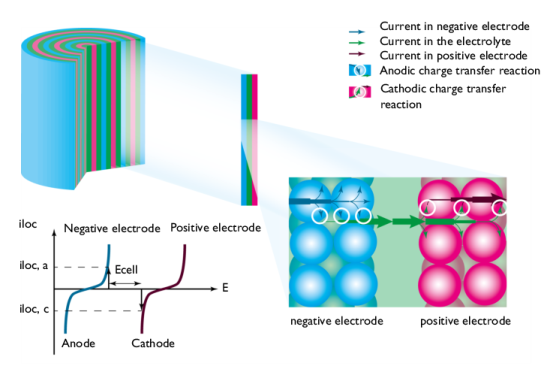
شکل 2: جهت جریان و جریان انتقال شارژ در حین تخلیه در باتری با الکترودهای متخلخل.
در حین تخلیه، انرژی شیمیایی در واکنش های انتقال بار در آند و کاتد به انرژی الکتریکی منتقل می شود. تبدیل مواد شیمیایی به انرژی الکتریکی در حین تخلیه ممکن است شامل واکنش های الکتروشیمیایی، انتقال جریان الکتریکی، انتقال یون ها و گونه های خنثی در الکترولیت، انتقال جرم در ذرات الکترود، جریان سیال و آزاد شدن گرما در تلفات غیر قابل برگشت باشد، مانند تلفات اهمی و تلفات ناشی از انرژی های فعال سازی.
شکل 2 یک تصویر شماتیک از فرآیند تخلیه را نشان می دهد. جریان از فیدر جریان در الکترود منفی وارد سلول می شود. واکنش انتقال بار در سطح مشترک بین ماده الکترود و الکترولیت موجود در الکترود متخلخل، که الکترولیت منفذی نیز نامیده میشود، رخ میدهد. در اینجا، اکسیداسیون مواد الکترود ممکن است از طریق یک واکنش انتقال بار آندی انجام شود کهدر شکل 2 i loc، a نشان داده شده است . شکل دو منحنی در نمودار با سینتیک الکترود برای مواد خاص توصیف شده است. این واکنش همچنین ممکن است شامل انتقال گونه های شیمیایی از الکترولیت منافذ و همچنین از ذرات الکترود باشد.
از الکترولیت منافذ، جریان با انتقال یون ها از طریق الکترولیت هدایت می شود که الکترود مثبت و منفی را (از طریق جداکننده یا مخزن) به الکترولیت منفذی در الکترود مثبت جدا می کند.
در سطح مشترک بین الکترولیت منافذ و سطح ذرات در الکترود متخلخل، واکنش انتقال بار، جریان الکترولیت را به جریان هدایت شده توسط الکترونهای الکترود مثبت منتقل میکند. در این رابط، کاهش ماده الکترود از طریق یک واکنش انتقال بار کاتدی انجام می شود که در شکل 3 i loc، c نشان داده شده است . همچنین در اینجا، واکنش انتقال بار ممکن است شامل انتقال گونههای شیمیایی در الکترولیت و ذرات الکترود باشد.
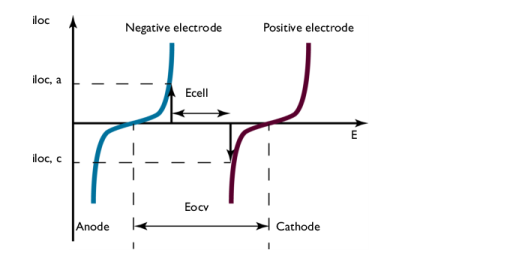
شکل 3: پلاریزاسیون الکترود در حین تخلیه. شکل مشابه شکل 2 است.
جریان از طریق کلکتور جریان از سلول خارج می شود. رسانش جریان و واکنش های انتقال بار الکتروشیمیایی نیز گرما را به دلیل تلفات اهمی، تلفات فعال سازی و سایر فرآیندهای برگشت ناپذیر آزاد می کند.
نمودار در شکل 3 چگالی جریان انتقال بار، i loc را به عنوان تابعی از پتانسیل الکترود، E نشان می دهد . این منحنی ها قطبش الکترودها را در حین تخلیه توصیف می کنند.
الکترود منفی در حین تخلیه به صورت آندی قطبی می شود، جریانی مثبت که با فلش در شکل 3 نشان داده شده است . پتانسیل الکترود منفی افزایش می یابد. الکترود مثبت به صورت کاتدی قطبی می شود، جریانی منفی که با فلش نشان داده شده است. پتانسیل الکترود مثبت کاهش می یابد.
در نتیجه، شکل 3 همچنین نشان میدهد که اختلاف پتانسیل بین الکترودها که در اینجا سلول E نشان داده میشود ، در طول تخلیه در مقایسه با ولتاژ سلول باز کاهش مییابد که در اینجا E ocv نشان داده میشود . مقدار سلول E ولتاژ سلول در یک جریان معین i loc است ، اگر تلفات اهمی در سلول ناچیز باشد. معمولا در اکثر باتری ها اینطور نیست. این بدان معناست که ولتاژ سلول در بیشتر موارد کمی کوچکتر از ولتاژ نشان داده شده در شکل 3 است .
در طول شارژ، فرآیندها معکوس می شوند. شکل 4 را ببینید . انرژی الکتریکی به انرژی شیمیایی تبدیل می شود که در باتری ذخیره می شود.
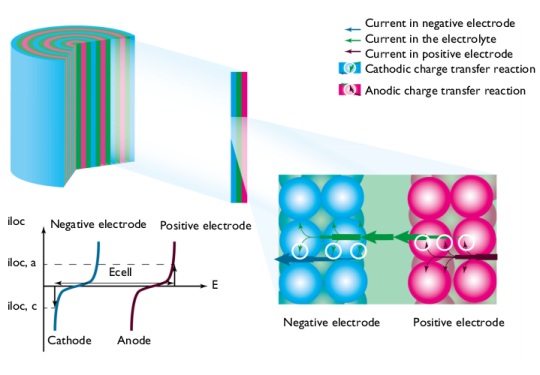
شکل 4: در هنگام شارژ، الکترود مثبت به عنوان آند و الکترود منفی به عنوان کاتد عمل می کند. ولتاژ سلول (در یک جریان معین) در مقایسه با ولتاژ سلول باز افزایش می یابد. توجه: جهت جریان در اینجا معکوس است.
جریان از الکترود مثبت وارد سلول می شود. در اینجا، در طول شارژ، اکسیداسیون محصولات از طریق یک واکنش انتقال بار آندی انجام می شود. الکترود مثبت به صورت آندی و با جریان مثبت پلاریزه می شود و پتانسیل الکترود افزایش می یابد.
سپس جریان از طریق الکترولیت منفذی، از طریق الکترولیت در جداکننده (یا مخزن) که الکترودها را جدا می کند، به الکترود منفی هدایت می شود.
در الکترود منفی، کاهش محصولات حاصل از واکنش تخلیه قبلی از طریق یک واکنش انتقال بار کاتدی انجام می شود. الکترود منفی به صورت کاتدی پلاریزه می شود و پتانسیل الکترود کاهش می یابد.
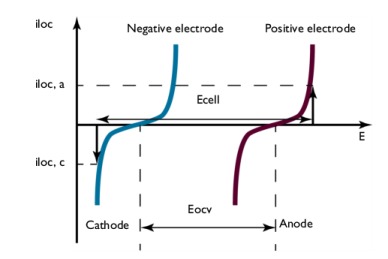
شکل 5: پلاریزاسیون الکترود در حین شارژ.
اختلاف پتانسیل بین الکترودها، که در اینجا سلول E نشان داده میشود ، در یک i loc معین ، در طول شارژ افزایش مییابد، در مقایسه با ولتاژ سلول باز، که در اینجا Eocv نشان داده میشود . شکل 5 را ببینید . مقدار سلول E برابر با ولتاژ سلول است که تلفات اهمی نادیده گرفته شود. در اکثر سلول ها این تلفات ناچیز نیست و به ولتاژ سلول می افزاید.
فرآیندها و پدیده های باتری شرح داده شده در شکل های بالا را می توان با استفاده از ماژول طراحی باتری بررسی کرد. رابطهای فیزیکی موجود در ماژول به شما امکان میدهد تأثیر روی عملکرد باتری و مدیریت حرارتی پارامترهایی مانند موارد زیر را بررسی کنید:
• | انتخاب مواد و شیمی |
• | ابعاد و هندسه کلکتورها و فیدرهای فعلی |
• | ابعاد و هندسه الکترودها |
• | اندازه ذراتی که الکترودهای متخلخل از آن ساخته شده اند |
• | تخلخل و سطح ویژه الکترود متخلخل |
• | پیکربندی اجزای باتری |
• | سینتیک واکنش های سطحی و توده ای |
• | سیکل های بار وابسته به جریان بالقوه یا اعمالی |
• | پیری سلول های الکتروشیمیایی |
مدل های توده ای
هنگام مدلسازی سیستمهای بزرگتر مانند بسته باتری، از جمله جزئیات هندسی دقیق لایههای باتری، ساختارهای الکترود و شیمی ممکن است از دیدگاه مدلسازی عملی نباشد. بسیاری از جزئیات در مورد سلول باتری ممکن است برای مدل ساز شناخته نشده باشد، و محدودیت های عددی (حافظه و زمان محاسباتی) ممکن است به نفع مدل های کمتر پیچیده باشد. برای این موارد، اغلب مدل سلول دقیق با عناصر سلول صفر بعدی سادهتر جایگزین میشود، که یک مدار معادل، باتری تودهای یا مدل تک ذره را تشکیل میدهد. به عنوان مثال، به جای یک توازن دقیق جرم و بار یونهای حامل بار در فاز الکترولیت در امتداد طول الکترود منفی، جداکننده و الکترود مثبت، همه سهمهای ولتاژ این پدیدهها به یک مقاومت واحد تبدیل میشوند.
در یک مدل بسته باتری تعدادی از این مدلهای صفر بعدی برای هر سلول باتری ترکیب میشوند تا توزیع جریان سلول به سلول بسته را تعریف کنند.
رابط های فیزیک مدل سازی باتری
رابط باتری لیتیوم یون (  ) مدلسازی دقیق باتریهای لیتیوم یون با استفاده از الکترولیتهای مایع است و شامل عملکردی است که انتقال گونههای باردار در الکترودهای متخلخل، الکترولیت، واکنشهای میانافزایی در الکترودها، بایندرها، واکنشهای انتقال بار، انتشار ذرات داخلی را توصیف میکند. ، وابستگی به دمای مقادیر انتقال، مکانیسم پیری و رابط الکترولیت جامد (SEI).
) مدلسازی دقیق باتریهای لیتیوم یون با استفاده از الکترولیتهای مایع است و شامل عملکردی است که انتقال گونههای باردار در الکترودهای متخلخل، الکترولیت، واکنشهای میانافزایی در الکترودها، بایندرها، واکنشهای انتقال بار، انتشار ذرات داخلی را توصیف میکند. ، وابستگی به دمای مقادیر انتقال، مکانیسم پیری و رابط الکترولیت جامد (SEI).
رابط رسانای تک یونی باتری لیتیوم یونی (  ) مشابه رابط فوق است، اما از یک پیش فرض متفاوت برای معادله تعادل شارژ در الکترولیت استفاده می کند که معمولاً برای الکترولیت های جامد مناسب است.
) مشابه رابط فوق است، اما از یک پیش فرض متفاوت برای معادله تعادل شارژ در الکترولیت استفاده می کند که معمولاً برای الکترولیت های جامد مناسب است.
رابط Single Particle Battery (  ) یک رویکرد ساده (در مقایسه با رابط باتری لیتیوم یونی) برای مدل سازی باتری ارائه می دهد. این رابط توزیع بار در باتری را با استفاده از یک مدل تک ذره جداگانه برای الکترودهای مثبت و منفی باتری مدل می کند. این عامل انتشار جامد در ذرات الکترود، سینتیک واکنش و افت پتانسیل اهمی در جداکننده را با استفاده از عبارت مقاومت محلول تودهای در نظر میگیرد.
) یک رویکرد ساده (در مقایسه با رابط باتری لیتیوم یونی) برای مدل سازی باتری ارائه می دهد. این رابط توزیع بار در باتری را با استفاده از یک مدل تک ذره جداگانه برای الکترودهای مثبت و منفی باتری مدل می کند. این عامل انتشار جامد در ذرات الکترود، سینتیک واکنش و افت پتانسیل اهمی در جداکننده را با استفاده از عبارت مقاومت محلول تودهای در نظر میگیرد.
باتری با رابط الکترولیت دوتایی (  ) هدایت جریان الکتریکی در الکترودها، واکنش های انتقال بار در الکترودهای متخلخل، انتقال جرم یون ها در الکترولیت منفذی و در الکترولیت جداکننده الکترودها، و درهم آمیختگی گونه ها را توصیف می کند. در ذرات تشکیل دهنده الکترودهای متخلخل. توضیحات برای سلولهای دارای الکترولیت دوتایی پایه، که هیدرید نیکل-فلز و باتریهای نیکل-کادمیم را پوشش میدهد، موجود است.
) هدایت جریان الکتریکی در الکترودها، واکنش های انتقال بار در الکترودهای متخلخل، انتقال جرم یون ها در الکترولیت منفذی و در الکترولیت جداکننده الکترودها، و درهم آمیختگی گونه ها را توصیف می کند. در ذرات تشکیل دهنده الکترودهای متخلخل. توضیحات برای سلولهای دارای الکترولیت دوتایی پایه، که هیدرید نیکل-فلز و باتریهای نیکل-کادمیم را پوشش میدهد، موجود است.
رابط Battery Lumped (  ) یک مدل باتری را بر اساس مجموعه کوچکی از پارامترهای توده ای تعریف می کند که نیازی به دانش ساختار داخلی یا طراحی الکترودهای باتری یا انتخاب مواد ندارد. مدل های ایجاد شده با رابط باتری انبوه معمولاً می توانند برای نظارت بر وضعیت شارژ و پاسخ ولتاژ باتری در طول چرخه بار استفاده شوند. این رابط همچنین یک منبع گرمای باتری را تعریف میکند که ممکن است به یک رابط انتقال حرارت برای مدلسازی خنکسازی باتری و مدیریت حرارتی متصل شود.
) یک مدل باتری را بر اساس مجموعه کوچکی از پارامترهای توده ای تعریف می کند که نیازی به دانش ساختار داخلی یا طراحی الکترودهای باتری یا انتخاب مواد ندارد. مدل های ایجاد شده با رابط باتری انبوه معمولاً می توانند برای نظارت بر وضعیت شارژ و پاسخ ولتاژ باتری در طول چرخه بار استفاده شوند. این رابط همچنین یک منبع گرمای باتری را تعریف میکند که ممکن است به یک رابط انتقال حرارت برای مدلسازی خنکسازی باتری و مدیریت حرارتی متصل شود.
مدار معادل باتری (  ) می تواند برای تعریف مدل باتری بر اساس تعداد دلخواه از عناصر مدار الکتریکی استفاده شود. مدلهایی که با مدار معادل باتری ایجاد میشوند معمولاً میتوانند برای نظارت بر وضعیت شارژ و پاسخ ولتاژ باتری در طول یک چرخه بار استفاده شوند. هنگام انتخاب مدار معادل باتری در مدل Wizard، این یک
) می تواند برای تعریف مدل باتری بر اساس تعداد دلخواه از عناصر مدار الکتریکی استفاده شود. مدلهایی که با مدار معادل باتری ایجاد میشوند معمولاً میتوانند برای نظارت بر وضعیت شارژ و پاسخ ولتاژ باتری در طول یک چرخه بار استفاده شوند. هنگام انتخاب مدار معادل باتری در مدل Wizard، این یک  رابط مدار الکتریکی ( ) به مدل اضافه می کند که شامل تعدادی از عناصر مدار از پیش تعریف شده است که برای تعریف ولتاژ مدار باز، جریان بار و مقاومت داخلی استفاده می شود. عناصر مدار اضافی مانند مقاومت، خازن و سلف ممکن است توسط کاربر اضافه شود.
رابط مدار الکتریکی ( ) به مدل اضافه می کند که شامل تعدادی از عناصر مدار از پیش تعریف شده است که برای تعریف ولتاژ مدار باز، جریان بار و مقاومت داخلی استفاده می شود. عناصر مدار اضافی مانند مقاومت، خازن و سلف ممکن است توسط کاربر اضافه شود.
رابط باتری سرب اسید (  ) برای این نوع باتری طراحی شده است و شامل عملکردی است که حمل و نقل گونه های باردار، واکنش های انتقال بار، تغییر تخلخل ناشی از شارژ و دشارژ، و میانگین سرعت سطحی الکترولیت ناشی از آن را توصیف می کند. تغییر در تخلخل
) برای این نوع باتری طراحی شده است و شامل عملکردی است که حمل و نقل گونه های باردار، واکنش های انتقال بار، تغییر تخلخل ناشی از شارژ و دشارژ، و میانگین سرعت سطحی الکترولیت ناشی از آن را توصیف می کند. تغییر در تخلخل
رابط بسته باتری (  ) دارای یک رویکرد یک به ممکن برای راه اندازی چندین مدل باتری یکپارچه و برای اتصال آنها در هندسه سه بعدی است. این رابط معمولاً همراه با رابط انتقال حرارت برای مدلسازی مدیریت بستههای حرارتی استفاده میشود. این رابط همچنین دارای رویدادهای حرارتی است که ممکن است برای مطالعه مشکلات انتشار فرار حرارتی استفاده شود.
) دارای یک رویکرد یک به ممکن برای راه اندازی چندین مدل باتری یکپارچه و برای اتصال آنها در هندسه سه بعدی است. این رابط معمولاً همراه با رابط انتقال حرارت برای مدلسازی مدیریت بستههای حرارتی استفاده میشود. این رابط همچنین دارای رویدادهای حرارتی است که ممکن است برای مطالعه مشکلات انتشار فرار حرارتی استفاده شود.
رابط های توزیع جریان، رابط های سلولی الکتروشیمیایی عمومی هستند. توزیع جریان سوم، رابط Nernst-Planck (  ) انتقال گونه های باردار در الکترولیت ها را از طریق انتشار، مهاجرت و همرفت توصیف می کند. علاوه بر این، شامل فرمول های آماده برای الکترودهای متخلخل و غیر متخلخل، از جمله واکنش های انتقال بار و هدایت جریان در هادی های الکترونیکی است.
) انتقال گونه های باردار در الکترولیت ها را از طریق انتشار، مهاجرت و همرفت توصیف می کند. علاوه بر این، شامل فرمول های آماده برای الکترودهای متخلخل و غیر متخلخل، از جمله واکنش های انتقال بار و هدایت جریان در هادی های الکترونیکی است.
رابط های حمل و نقل گونه های شیمیایی (  ) را می توان برای توصیف انتقال یون های کمیاب در الکترولیت منفذی و در الکترولیتی که آند و کاتد را جدا می کند استفاده کرد. واکنشهای دیگری غیر از واکنشهای الکتروشیمیایی خالص را میتوان اضافه کرد تا مثلاً تجزیه مواد را توصیف کند. در ترکیب با رابط توزیع جریان ثانویه (
) را می توان برای توصیف انتقال یون های کمیاب در الکترولیت منفذی و در الکترولیتی که آند و کاتد را جدا می کند استفاده کرد. واکنشهای دیگری غیر از واکنشهای الکتروشیمیایی خالص را میتوان اضافه کرد تا مثلاً تجزیه مواد را توصیف کند. در ترکیب با رابط توزیع جریان ثانویه (  ) ، رابط حمل و نقل گونه های متمرکز (
) ، رابط حمل و نقل گونه های متمرکز (  ) و رابط انتقال گونه های رقیق شده در محیط متخلخل (
) و رابط انتقال گونه های رقیق شده در محیط متخلخل (  ) می توانند برای مدل سازی انتقال گونه های باردار و واکنش های الکتروشیمیایی در اکثر سیستم های باتری استفاده شوند. .
) می توانند برای مدل سازی انتقال گونه های باردار و واکنش های الکتروشیمیایی در اکثر سیستم های باتری استفاده شوند. .
رابط Chemistry (  ) که در شاخه Chemical Species Transport یافت می شود، می تواند برای تعریف سیستم های گونه های واکنش دهنده، واکنش های الکترود و واکنش های شیمیایی معمولی استفاده شود. به این ترتیب، به عنوان یک ارائه دهنده سینتیک واکنش و خواص مواد به رابط های حمل و نقل وابسته به فضا، مانند توزیع جریان سوم، رابط Nernst-Planck، یا رابط حمل و نقل گونه های رقیق شده، عمل می کند.
) که در شاخه Chemical Species Transport یافت می شود، می تواند برای تعریف سیستم های گونه های واکنش دهنده، واکنش های الکترود و واکنش های شیمیایی معمولی استفاده شود. به این ترتیب، به عنوان یک ارائه دهنده سینتیک واکنش و خواص مواد به رابط های حمل و نقل وابسته به فضا، مانند توزیع جریان سوم، رابط Nernst-Planck، یا رابط حمل و نقل گونه های رقیق شده، عمل می کند.
رابطهای جریان سیال (  ) جریان سیال را در الکترودهای متخلخل و در محیطهای آزاد توصیف میکنند، اگر برای نوع خاصی از باتری، به عنوان مثال، انواع خاصی از باتریهای سرب اسیدی مرتبط باشد.
) جریان سیال را در الکترودهای متخلخل و در محیطهای آزاد توصیف میکنند، اگر برای نوع خاصی از باتری، به عنوان مثال، انواع خاصی از باتریهای سرب اسیدی مرتبط باشد.
رابط انتقال حرارت در رسانه متخلخل (  ) انتقال حرارت را در سلول ها توصیف می کند. این شامل اثرات گرمایش ژول در مواد الکترود و در الکترولیت، گرم شدن ناشی از تلفات فعال سازی در واکنش های الکتروشیمیایی، و تغییر خالص آنتروپی است. گرمای حاصل از واکنشهای غیر از واکنشهای الکتروشیمیایی را میتوان با این رابطهای فیزیک توصیف کرد. رابطهای انتقال حرارت نیز با قابلیتهای سفارشی برای همگنسازی مواد باتری لایهای، که معمولاً در شبیهسازی حرارتی بستههای باتری استفاده میشوند، گسترش یافتهاند.
) انتقال حرارت را در سلول ها توصیف می کند. این شامل اثرات گرمایش ژول در مواد الکترود و در الکترولیت، گرم شدن ناشی از تلفات فعال سازی در واکنش های الکتروشیمیایی، و تغییر خالص آنتروپی است. گرمای حاصل از واکنشهای غیر از واکنشهای الکتروشیمیایی را میتوان با این رابطهای فیزیک توصیف کرد. رابطهای انتقال حرارت نیز با قابلیتهای سفارشی برای همگنسازی مواد باتری لایهای، که معمولاً در شبیهسازی حرارتی بستههای باتری استفاده میشوند، گسترش یافتهاند.
رابط مکانیک جامد (  ) با عملکردی برای مدلسازی کرنش الکترود بهدلیل، بهعنوان مثال، تداخل لیتیوم در الکترودهای گرافیتی گسترش یافته است.
) با عملکردی برای مدلسازی کرنش الکترود بهدلیل، بهعنوان مثال، تداخل لیتیوم در الکترودهای گرافیتی گسترش یافته است.




