خواص ترمودینامیکی ارائه شده به عنوان ویژگی گونه و مخلوط در یک بسته Property ذکر شده است.
گاز ایده آل
قانون گاز ایده آل مستقل از ترکیب است و V را در T و P مشخص می کند . چگالی را می توان از
(10-102)
ضرایب فوگاسیتی جزئی
(10-103)
آنتالپی گاز ایده آل برای مخلوط
(10-104)
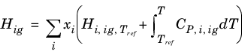
که در آن H i,ig,T ref آنتالپی یک گاز ایده آل را به آنتالپی در حالت مرجع انتخاب شده برای گونه i مرتبط می کند .
آنتروپی گاز ایده آل برای گونه های i
(10-105)
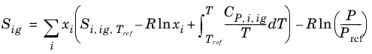
که در آن S i,ig,T ref آنتروپی یک گاز ایده آل به آنتروپی گونه ها در حالت مرجع انتخاب شده است.
انرژی آزاد گیبس از آن ناشی می شود
(10-106)
معادله حالت
معادله حالت V را در x ، T و P مشخص می کند . چگالی را می توان به صورت معادله 10-102 بیان کرد . ضرایب فوگاسیتی جزئی از آن مشتق شده است
(10-107)
که در آن V i حجم مولی جزئی است. انرژی آزاد آنتالپی، آنتروپی و گیبس از ضرایب فوگاسیته جزئی و سهم گاز ایده آل به شرح زیر است:
(10-108)
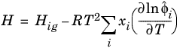
(10-109)
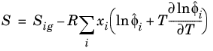
(10-110)
ظرفیت گرمایی
ظرفیت حرارتی در فشار ثابت از محاسبه می شود
(10-111)
زمانی که آنتالپی در دسترس باشد در دسترس است. ظرفیت گرمایی در حجم ثابت با تعریف می شود
(10-112)
رابطه بین ظرفیت گرمایی در فشار ثابت و حجم ثابت را می توان به صورت زیر بیان کرد:
(10-113)
were v تابعی از T و P است . یک بسط تیلور از v در ترکیب ثابت می دهد
(10-114)
بازآرایی معادلات بالا می دهد
(10-115)
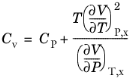
اگر Cp و حجم موجود باشد و سیال به وسیله حجم به فشار قابل تراکم باشد، Cv در دسترس است. برای گاز ایده آل معادله 10-113 را به صورت بیان کنید
(10-116)
نسبت ظرفیت گرمایی ویژه به صورت تعریف شده است
(10-117)
مدل های ضریب فعالیت
آنتالپی، آنتروپی و انرژی آزاد گیبس از ضرایب فعالیت و سهم گاز ایده آل در معادله 10-104 – معادله 10-106 پیروی می کنند . ضرایب فعالیت انحراف پتانسیل های شیمیایی از فاز مایع ایده آل را توصیف می کند، بنابراین گرمای تبخیر باید در نظر گرفته شود.
(10-118)
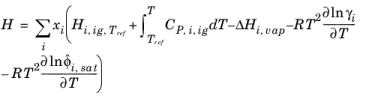
(10-119)
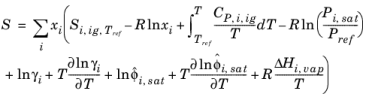
(10-120)
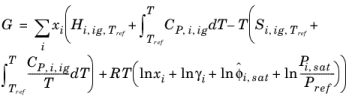
توجه داشته باشید که اگر فاز بخار ایدهآل باشد، میتوان از فوگاسیته اشباع شده،  سهم صرف نظر کرد.
سهم صرف نظر کرد.
سایر خواص
فوگاسیتی جزئی از محاسبه می شود
(10-121)
انرژی داخلی از محاسبه می شود
(10-122)
که در آن U i,ig,ref آنتالپی یک گاز ایده آل به آنتالپی گونه در حالت مرجع انتخاب شده است.
انرژی هلمهولتز از محاسبه می شود
(10-123)
مقادیر K برای فازهای p و q از آن گرفته شده است
(10-124)
اگر فقط فازهای مایع تعریف شده باشد، محاسبه مقدار K به کاهش می یابد
(10-125)
(10-126)




